Kiedy stosuje się zabieg in vitro?
Zapłodnienie pozaustrojowe daje możliwość posiadania dzieci w sytuacji, gdy inne metody leczenia niepłodności okazały się nieskuteczne lub z góry wiadomo, że nie mają szansy powodzenia.
Spośród wszystkich metod leczenia niepłodności IVF ( zapłodnienie pozaustrojowe) jest metodą najskuteczniejszą, stosowaną z powodzeniem od ponad 40 lat. Za jej opracowanie dr Robert Edwards został w 2010 r. uhonorowany najbardziej prestiżową nagrodą – Nagrodą Nobla w dziedzinie medycyny.
Wskazania do in vitro
Poniższa lista przedstawia wskazania w formie rekomendacji, zgodnie z zaleceniami Polskiego Towarzystwa Medycyny Rozrodu, Sekcji Płodności i Niepłodności oraz Sekcji Andrologii Polskiego Towarzystwa Ginekologicznego. Należy jednak pamiętać o tym, że przypadek każdej pary starającej się o wykonanie zapłodnienia in vitro rozpatrywany jest indywidualnie. Jakie czynniki wpływają na podjęcie decyzji o tej metodzie leczenia?
Czynnik jajowodowy:
Ze względu na stan zdrowia jajowodów wskazania do zabiegu in vitro mają pary, w których kobiety:
- cierpią na trwałe uszkodzenia jajowodów oraz ze względu na brak szans powodzenia zabiegu operacyjnego leczenia jajowodów nie zostały do niego zakwalifikowane,
- mają stwierdzone upośledzenie funkcji jajowodów przy zachowanej drożności,
- po zabiegu mikrochirurgicznym i upływie maksymalnie 2 lat bezskutecznie próbowały zajść w ciążę.
- Oczekiwanie na ciążę może być racjonalne tylko w przypadku braku innych możliwych przyczyn niepłodności (niskiej jakości nasienia, wieku kobiety powyżej 35 lat, endometriozy, zaburzeń jajeczkowania).
Niepłodność niewyjaśnionego pochodzenia
O niepłodności idiopatycznej, czyli takiej, której przyczyn nie można zdiagnozować mówimy wówczas, gdy trwa ona powyżej dwóch lata. W przypadku kobiet, które ukończyły 35. rok życia, o niepłodności idiopatycznej można mówić szybciej.
Czynnik męski
Wskazania do in vitro równie często wynikają z problemów z niepłodnością męską. Należą do nich:
- wskazana mikroiniekcja plemnika do komórki jajowej (ICSI), czyli zapłodnienie jajeczka plemnikiem w warunkach laboratoryjnych,
- liczba plemników w 1 mililitrze nasienia poniżej 3 milionów,
W przypadku gęstości plemników 3-15 mln/ml postępuje się tak jak w przypadku niepłodności o niewyjaśnionym pochodzeniu.
Endometrioza
Endometrioza jest chorobą, która polega na tym, że komórki śluzówki macicy zamiast opuszczać organizm, rozchodzą się wewnątrz narządów rodnych, wywołując torbiele, guzki i zrosty, a także krwawiąc.
- W przypadku endometriozy pierwszego i drugiego stopnia postępuje się tak jak w niepłodności idiopatycznej,
- W przypadku endometriozy trzeciego i czwartego stopnia wskazania są takie same jak w przypadku czynnika jajowodowego.
Zaburzenia hormonalne po ewentualnym niepowodzeniu inseminacji
Sześć cyklów ze stymulacją owulacji, które nie przyniosły efektu lub gdy stosowana stymulacja doprowadza do rozwoju wielu pęcherzyków.
Inne wskazania
- Nosicielstwo wirusów HIV, HCV przez mężczyznę (kobieta nie jest zarażona).
- Nosicielstwo zmian genetycznych powodujących ciężkie, nieodwracalne zmiany u potomstwa (gdy diagnostyka preimplantacyjna pozwala uniknąć trudnej decyzji o przerwaniu ciąży).
- Leczenie przeciwnowotworowe, które z dużym prawdopodobieństwem nieodwracalnie uszkodzi jajniki.
- Przedwczesne wygaśnięcie czynności jajników (zastosowanie komórki jajowej dawczyni).
Przygotowania do in vitro
Przygotowanie pary do przeprowadzenia zapłodnienia pozaustrojowego in vitro mają na celu zwiększenie prawdopodobieństwa powodzenia zabiegu. Przygotowania do in vitro obejmują:
- wywiad medyczny dotyczący obojga partnerów, ze szczególnym uwzględnieniem czynników mogących mieć wpływ na bezpieczeństwo zastosowania IVF, oraz określenie przybliżonego rokowania co do powodzenia leczenia,
- badanie ginekologiczne obejmujące badania cytologiczne, prawidłowe pH pochwy (posiewy w przypadku prawidłowego pH nie są wskazane),
- badanie nasienia, a w przypadku nieprawidłowego wyniku ewentualne badania dodatkowe takie jak: kariotyp, mutacje CFTR, AZF jest badaniem nieobowiązkowym (gdy liczba plemników jest mniejsza niż 5 mln/ml),
- badanie USG narządu rodnego,
- dokładna ocena rezerwy jajnikowej – ocena liczby pęcherzyków antralnych w USG, badania hormonalne (AMH, FSH),
- badania związane z zabiegiem punkcji jajników (pobrania komórek jajowych w krótkotrwałym znieczuleniu ogólnym dożylnym) – morfologia, elektrolity, APTT, grupa krwi,
W przygotowaniach do zabiegu in vitro badania są również wykonywane również w kierunku nieprawidłowości występujących u jednego z partnerów.
Dodatkowe badania dla kobiet:
- anty-Hbc, antygen Hbs, anty-HCV, anty-HIV 1-2, VDRL.
- Chlamydia trachomatis (PCR),
- toksoplazamoza, różyczka, cytomegalovirus (przeciwciała IgM, IgG),
- biocenoza pochwy,
Dodatkowe badania dla mężczyzn:
- anty-Hbc, antygen Hbs, anty-HCV, anty-HIV 1-2, VDRL,
- cytomegalovirus (przeciwciała IgM, IgG),
- grupa krwi.
Przebieg in vitro – na czym polega?
Na przebieg in vitro składają się cztery etapy. Jakie są kolejne kroki w przeprowadzaniu zapłodnienia pozaustrojowego?
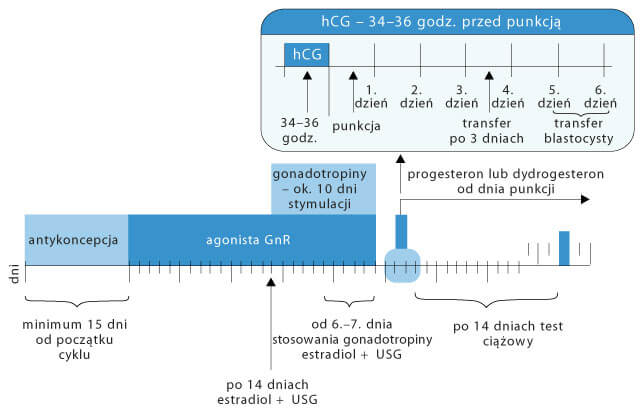
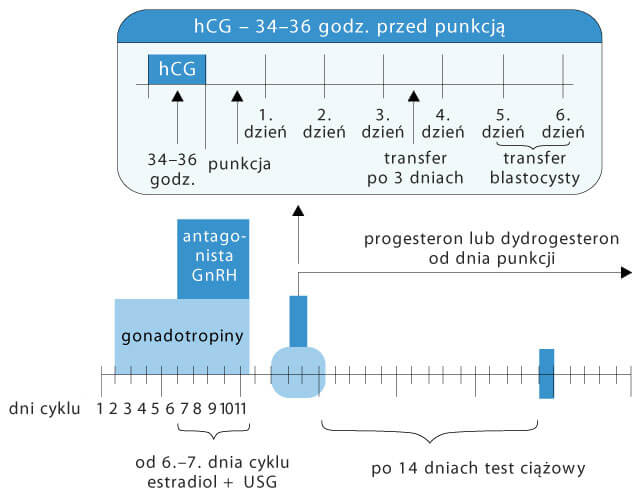
1. Stymulacja owulacji
Głównym celem stymulacji owulacji jest uzyskanie większej niż w cyklu naturalnym liczby dojrzałych komórek jajowych. Zwiększa to szansę na uzyskanie zarodków, umożliwia mrożenie zarodków i tym samym zwiększa całkowite prawdopodobieństwo uzyskania ciąży. Podczas prawidłowej stymulacji owulacji dochodzi do zsynchronizowanego dojrzewania kilku pęcherzyków w jajniku.
Obecnie stosowane są następujące protokoły stymulacyjne (kolejność w zależności od częstości stosowania):
- długi protokół in vitro z agonistą gonadoliberyny (GnRH-a),
- krótki protokół in vitro z antagonistą GnRH,
- protokół krótki z GnRH-a.
2. Pobranie komórek jajowych
W krótkotrwałym znieczuleniu ogólnym dożylnym pod kontrolą USG wprowadza się przez pochwę do jajnika specjalną cienką igłę i pobiera się po kolei z każdego pęcherzyka płyn oraz komórkę jajową. Zabieg ten przeprowadzany jest ambulatoryjnie i trwa około 25 minut. Po kilkugodzinnym pobycie w klinice pacjentka odbywa konsultację lekarską i po wypisaniu może wrócić do domu. Należy pamiętać o tym, że przez 24 godziny po punkcji (znieczuleniu) nie można prowadzić pojazdów mechanicznych.
3. Etap laboratoryjny
W Pracowni Rozrodu Wspomaganego komórki jajowe są oddzielane od płynu pęcherzykowego i umieszczane w specjalnym płynie (podłożu). W tym czasie partner oddaje nasienie drogą masturbacji. Następnie jest ono odpowiednio przygotowywane. Jeżeli nasienie spełnia odpowiednie parametry to przygotowane plemniki umieszcza się razem z komórkami jajowymi. W przypadku nieprawidłowości nasienia proponujemy parom technikę mikroiniekcji – ICSI. Do zapłodnienia dochodzi w inkubatorze utrzymującym specjalne warunki fizyczne (stałą temperaturę 37 st. C, 5 % CO2, 5% 02 i odpowiednią wilgotność).
4. Transfer zarodków in vitro
Przeniesienie zarodka (zarodków) do macicy (embryotransfer – ET) jest jednym z ostatnich etapów leczenia metodą IVF.
Podanie zarodka wykonuje się pomiędzy drugą a szóstą doba od pobrania komórek jajowych.
ICSI
Jest to podanie plemnika do komórki jajowej – (ICSI – ang. IntraCytoplasmic Sperm Injection). Metoda ta umożliwia uzyskanie ciąży nawet w przypadku występowania w nasieniu pojedynczych plemników (norma to dziesiątki milionów).
Przebieg ICSI
W części etapów procedury są takie same jak przy klasycznym zapłodnieniu pozaustrojowym (IVF) Różnica w wykonywanych procedurach obejmuje wyłącznie etap laboratoryjny. W klasycznym in vitro komórki łączy się z nasieniem i pozwala im w naturalny sposób zapłodnić komórkę jajową. W przypadku ICSI plemnik podawany jest do komórki jajowej przez laboranta.
Etap laboratoryjny mikroiniekcji
W laboratorium w płynie pęcherzykowym wyszukiwane są komórki jajowe. Po przygotowywaniu nasienia embriolog pod bardzo dużym powiększeniem za pomocą mikromanipulatora chwyta plemnik o prawidłowej budowie do cienkiej pipety iniekcyjnej (7µm). Następnie ten właśnie prawidłowy plemnik jest podawany do środka komórki jajowej.
IMSI
IMSI (z ang. Intracytoplasmic Morphologically Selected Sperm Injection), oznacza docytoplazmatyczną iniekcję plemnika, wyselekcjonowanego pod względem morfologicznym za pomocą techniki dużych powiększeń i wysokiej rozdzielczości. Metoda IMSI jest oparta na metodzie ICSI, różni się natomiast sposobem wyboru plemnika, który zostanie użyty do mikroiniekcji.
Dodatkowe zabiegi w procedurze in vitro
MESA
Micro-Epidydymal Sperm Aspiration – metoda ta pozwala na uzyskanie potomstwa u mężczyzn z azoospermią, u podstaw której leży niedrożność lub brak nasieniowodów. W krótkim znieczuleniu ogólnym dożylnym plemniki pobierane są z najądrza. Po odpowiednim ich przygotowaniu dalsze postępowanie nie różni się zdecydowanie od mikroiniekcji plemnika do komórki jajowej tzn.:
- stymulacji owulacji,
- pobrania komórek jajowych,
- iniekcji plemnika do komórki jajowej,
- obserwacji rozwoju zarodków,
- transferu embrionów i ich zamrożenia.
Metoda ta pozwala na uzyskanie potomstwa u mężczyzn z azoospermią spowodowaną nieprawidłową funkcją kanalików jądrowych.
Laser Assisted Hatching
Laser Assisted Hatching to system umożliwiający laserowe nacinanie osłonki przezroczystej zarodków. Zabieg ten jest wykonywany po to aby ułatwić zarodkowi implantację w ścianie macicy wtedy, gdy osłonka przeźroczysta zarodka stanowi zbyt dużą przeszkodę. Technika wykorzystuje silnie zogniskowaną wiązkę lasera w celu usunięcia niewielkiego obszaru zewnętrznej osłonki zarodka w niezwykle precyzyjny sposób.
Przedłużona obserwacja zarodków do stadium blastocysty
Rutynowym postępowaniem w trakcie procedury zapłodnienia pozaustrojowego jest obserwowanie, jak przebiega rozwój zarodków in vitro jeszcze przed ich transferem do jamy macicy w drugiej lub trzeciej dobie po zapłodnieniu (stadium 4-9 komórek).
Gdy w 3 dobie nie możemy wybrać zarodka o zachowanym potencjale rozwojowym podejmujemy decyzję o przedłużeniu obserwacji do 5 doby, czyli do stadium blastocysty.
Konserwacja (mrożenie) komórek jajowych i zarodków
Witryfikacja – jest to przejście ze stanu ciekłego do stałego bez tworzenia się kryształów lodu. Polega ona na bardzo szybkim schładzaniu komórki jajowej/zarodka wraz krioprotektantem z prędkością 20.000 stopni Celsjusza na minutę do temperatury poniżej -150°C.
Primo vision (system ciągłego monitorowania zarodków)
Jest to system do ciągłego obrazowania rozwoju zarodków in vitro (w inkubatorze) z możliwością zapamiętywania i późniejszej analizy obrazów z poszczególnych etapów rozwoju zarodka.
System Primo Vision, polegający na umieszczeniu kamery-mikroskopu bezpośrednio w inkubatorze, w którym zarodek się znajduje. Dzięki temu mamy możliwość:
- ciągłej obserwacji procesu rozwoju zarodków,
- obserwacji zarodków bez wyjmowania ich z inkubatora.
W systemie Primo Vision, rozwój każdego zarodka jest indywidualnie monitorowany od chwili zapłodnienia do dnia transferu. Zdjęcia są zbierane z wysoką częstotliwością, nawet co 5 minut. Z uzyskanych w ten sposób zdjęć system tworzy swoisty film pozwalający dostrzec i uwydatnić procesy rozwoju embrionu, które normalnie zachodzą bardzo wolno.
Przewagę tak prowadzonej obserwacji nad tradycyjnym sposobem oceny zarodków stanowi brak konieczności wyjmowania zarodków z inkubatora. Dzięki temu zarodki stale znajdują się w optymalnym dla nich środowisku i nie są narażone na niekorzystne zmiany pH, temperatury czy nieobojętny wpływ światła o dużej intensywności.
Jakie są wskazania do Primo Vision
System ciągłego monitorowania zarodków może więc istotnie pomóc w wyborze do embriotransferu zarodków najlepiej prognozujących, zwiększając tym samym szansę na urodzenie zdrowego dziecka, zwłaszcza u par:
- po niepowodzeniach pozaustrojowego zapłodnienia;
- u których otrzymujemy dużą liczbę zarodków o identycznej morfologii (nie jest możliwy idealny wybór zarodka do transferu).
Metoda, ułatwiając identyfikację zarodków o największym potencjale rozwojowym nawet na wczesnych etapach rozwoju, może być również pomocna w ograniczeniu liczby zarodków przenoszonych do macicy, dzięki czemu zmniejszony zostanie odsetek ciąż mnogich po zabiegach zapłodnienia in vitro.